|
|
|
|
|
|
|
|
Нанопоры в молекулярной биологии
|
Вы скажите,- на то она и молекулярная, чтобы "нано" -, и будете не правы, - методы этой науки чаще всего носят групповой, статистический, косвенный харакрер. Некоторые
размерные
ориентиры наномира: типичная
длина связи между двумя атомами составляет приблизительно 0,15 нм диаметр атома
углерода 0,15 нм постоянная
решетки графена 0,246 нм диаметр иона калия составляет
0,266 нм молекула
гемоглобина 5,5 нм вирусы в
диапазоне 30 - 200 нм длина волны
света, занимают участок спектра с длиной волны приблизительно от
380 (фиолетовый) до 780 нм (красный). |
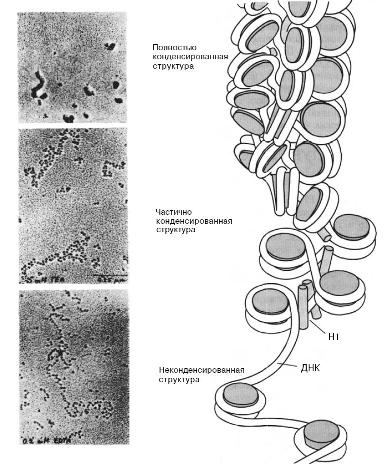
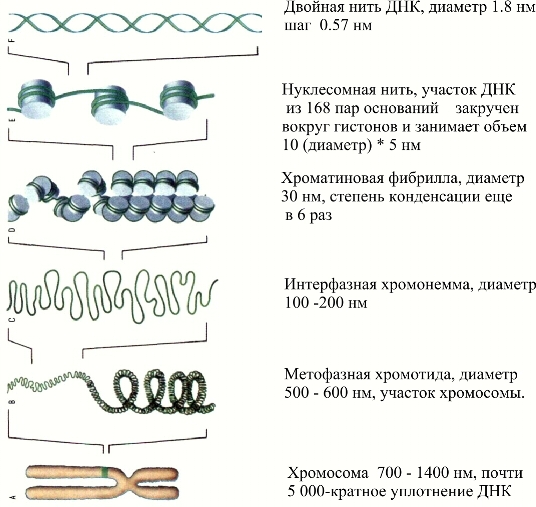
фиг.1 Степени конденсации ДНК. |
Фиг.2 Структура и поведение ДНК http://www.bio-cat.ru/info.php?id=17 |
И, наконец, размерные параметры святой коровы молбиол - ДЕЗОКСИРИБОНУКЛЕИНОВОЙ КИСЛОТЫ (ДНК) иллюстрируются фиг. 1,2 Для начала кое-что о средствах, позволяющих заглянуть в наномир.
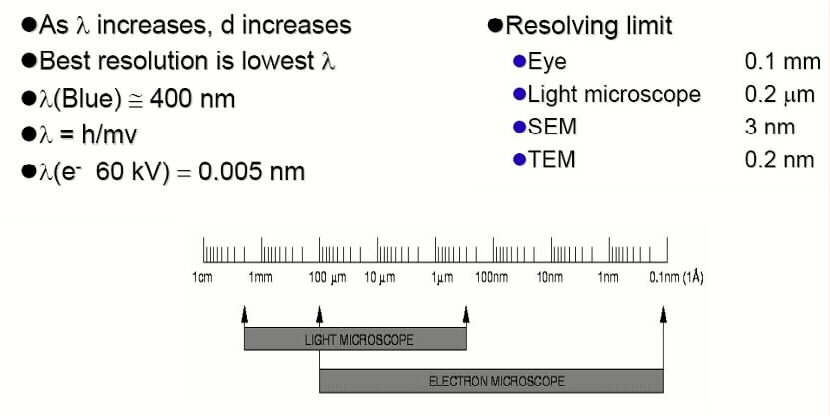
Основным инструментом познания здесь, безусловно, считается сканирующий
электронный микроскоп (SEM Scanning electron microscope) |

|
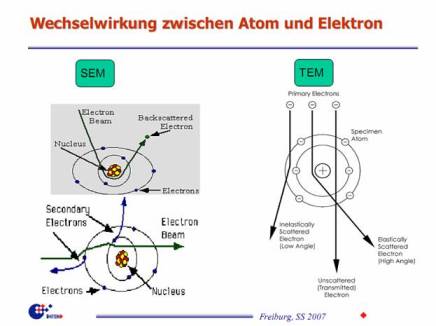
Кроме сканирующего SEM, в котором электронный луч в вакууме пробегает растром по образцу, а анализируются вторичные электроны, есть еще проекционный TEM (Transmissionselektronenmikroskop), где параллельный пучок электронов рассеивается на тонком препарате-образце и фокусируется в увеличенном масштабе на плоскость приемника. http://www.imtek.de/cpi/images/images/vl-ofa/2007-vl-ofa-06-topografie-elektronenmikroskopie.pdf Не станем в контексте рассматривать атомный силовой микроскоп, который в большей степени является манипулятором, чем регистратором.Сегодняшняя точность этих микроскопов составляет 3 нм для SEM и 0.2 нм для TEM. Хотя электронной микроскопии уже 80 лет и еще в сороковых Кембриджский инструмент давал точность в 40 нм, только в эру компьютеров смогли появиться приборы, пригодные для специалистов широкого профиля. |
фиг.5 Средства познания наномира |
|
. Проекционные
микроскопы сегодня дают бОльшее разрешение, но эти приборы работают только с
тонкими образцами, пленками и слоями напыления. Гораздо перспективнее более
молодые SEMы. (фиг.4) Они работают с объемными объектами и могут давать
компьютерной программе в реальном времени по ходу развертывания растра
информацию об интенсивности потока вторичных электронов от поверхности объекта.
Другие датчики регистрируют наведенное излучение в разных зонах спектра, от
рентгеновского до инфракрасного. Сканирование может проводиться сначала электронным
лучом с малой энергией, затем с большей и так вплоть до разрушения объекта. За
несколько сканирований собирается большой массив информации, после обработки
которой, на экран монитора выводится
картинка объекта, при необходимости в условных цветах и разных проекциях. Возможности
SEM безусловно будет расти по мере совершенствования электронной оптики, ведь
длина волны электронного луча очень мала и теоретическое разрешение далеко не исчерпано. |
фиг.3 Взаимодействия между атомами мишени и электронами облучающего пучка. |
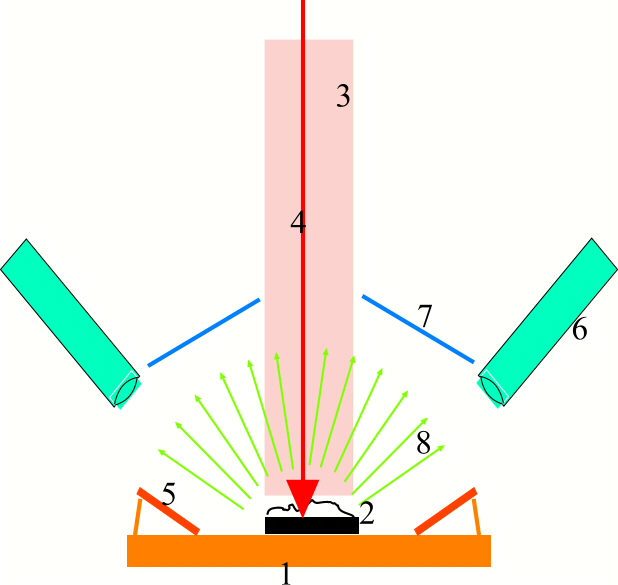
фиг.4 Работа сканирующего микроскопа. 1 - одноразовый кремниевый чип. 2 - исследуемый объект 3- зона сканирования объекта, например 2х2 нм. 4- сканирующий электронный луч 5 - заинтегрированные на чипе приемники "мягких" вторичных электронов 6 - внечиповые приемники вторичных электронов, ренгеновского, светового и теплового излучения 7 - отражатели 8 - наведенные излучения и потоки |
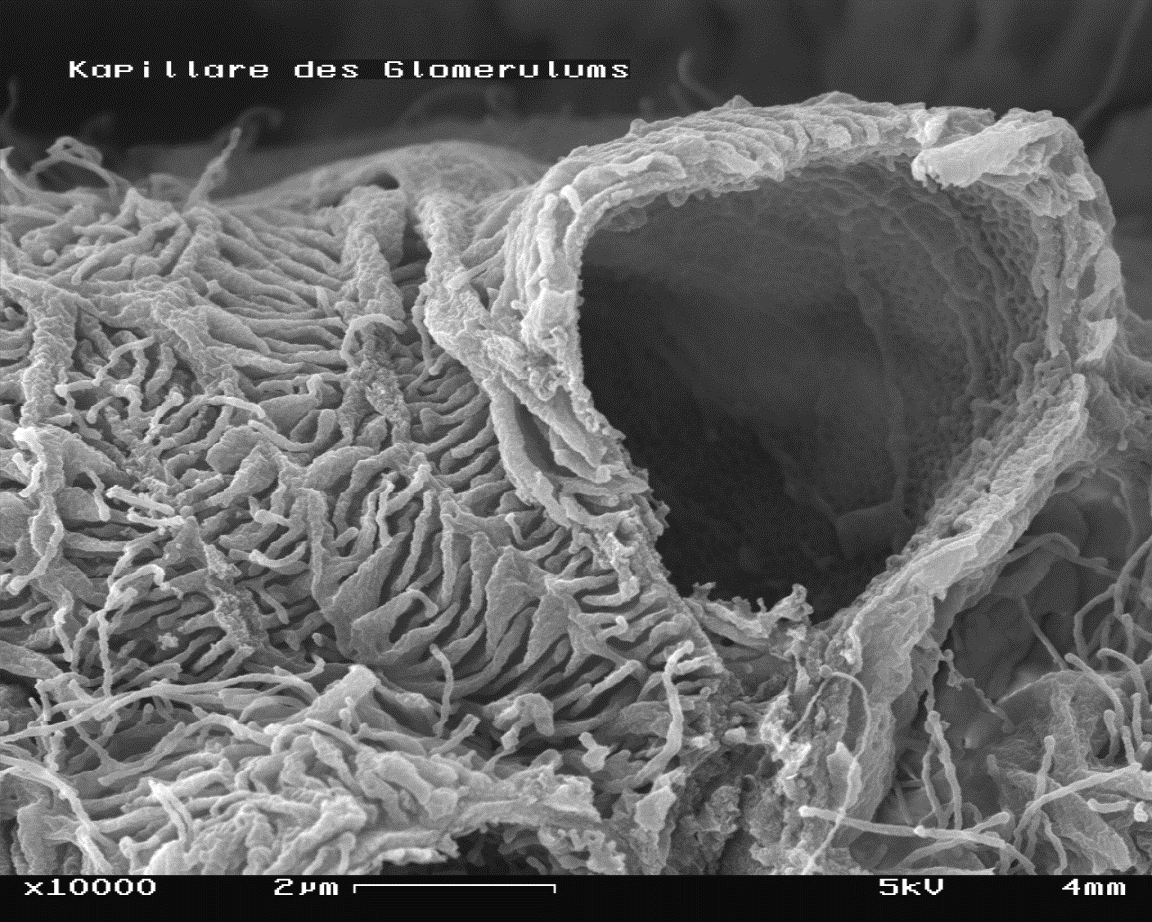
Фиг.
6 В биологии и
медицине сканирующие микроскопы уже заменили световые (препарат почки)
|
Откуда есть пошла... нана в молбиол, как
появилась идея работы с отдельной молекулой, кто первый и когда использовал
биологическую нанопору на диафрагме между двумя объемами электролита для
анализа биополимеров и ДНК в частности. Это был Хаганом
Бэйли (Hagan Bayley) из Оксфорда. Вот его работы,
после публикации которых, в эту новую нишу устремились десятки исследователей
по всему миру. -switches_in_a_self-assembling_pore-forming_protein 1994: Bayley H http://www.biomedexperts.com/Abstract.bme/9383441/A_ -photogenerated_pore-forming_protein 1995: Chang C Y; Niblack B; Walker
B; Bayley H
BACKGROUND: The permeabilization of cells
with bacterial pore-forming proteins is an important technique in cell biology
that allows the exchange of small reagents into the cytoplasm of a cell.
Another notable technology is the use of caged molecules whose activities are
blocked by addition of photoremovable protecting groups. This allows the
photogeneration of reagents on or in cells with spatial and temporal control.
Here, we combine these approaches to produce a caged pore-forming protein for
the controlled permeabilization of cells. RESULTS:
2-Bromo-2-(2-nitrophenyl)acetic acid (BNPA), a water-soluble cysteine-directed
reagent for caging peptides and proteins with the alpha-carboxy-2-nitrobenzyl
(CNB) protecting group, was synthesized. Glutathione (gamma-Glu-Cys-Gly) was
released in high yield from gamma-Glu-CysCNB-Gly by irradiation at 300 nm.
Based on this finding, scanning mutagenesis was used to find a single-cysteine
mutant of the pore-forming protein staphylococcal alpha-hemolysin (alpha HL)
suitable for caging. When alpha HL-R104C was derivatized with BNPA,
pore-forming activity toward rabbit erythrocytes was lost. Near UV irradiation
led to regeneration of the cysteine sulfhydryl group and the restoration of
pore-forming activity. CONCLUSIONS:
Caged pore-forming proteins are potentially useful for permeabilizing one cell
in a collection of cells or one region of the plasma membrane of a single cell.
Therefore, alpha HL-R104C-CNB and other caged proteins designed to create pores
of various diameters should be useful for many purposes. For example, the
ability to introduce reagents into one cell of a network or into one region of
a single cell could be used in studies of neuronal modulation. Further, BNPA
should be generally useful for caging cysteine-containing peptides and
single-cysteine mutant proteins to study, for example, cell signaling or
structural changes in proteins. В
лаборатории Бэйли исследовал генетику протеинового обмена через
мембраны и, в частности, занимался вопросами порообразующей
деятельности токсина альфа-гемолизин (альфе-hemolysin 7AHL), выделяемого бактерией золотистого стафилококка (Staphylococcus aureus). Этот токсин, как следует из названия,
разрушает клетки крови. Белок растворим, имеет массу 33,2 kDa и,
распространяясь по плазме крови, цитолитически воздействует на различные типы
клеток, включая моноциты, лимфоциты,
эритроциты, тромбоциты и эндотелиоциты человека.
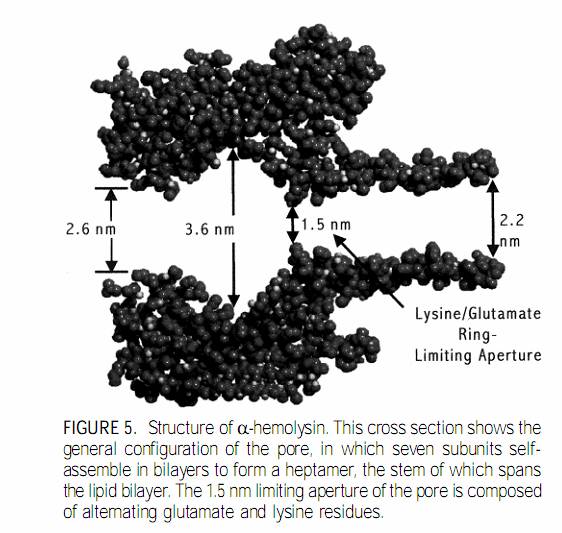
Механизм его действия таков: белок находит родственную его природе мембрану,
закрепляется на ней, прорастает через стенку и формирует структуру,
изображенную на фиг. 7. На этом цикл его деятельности прекращается, клетка же
через образовавшиеся поры теряет ионы калия и погибает. Это не единичный феномен, подобные белки,
способные встраиваться в клеточные мембраны, образуя в них поры и нарушая тем
самым способность клетки контролировать мембранный транспорт, встречаются у
многих инфекционных бактерий. На фиг.9 есть ссылка и показаны поры с
отверстиями разной формы и размеров. Подобный же механизм используют некоторые
вирусы, через встраиваемую пору они вводят в клетку хозяина свою ДНК. Однако, с легкой
руки Хагана Бэйли, именно альфа-гемолизин 7AHL стал
использовался в лабораториях мира в экспериментах с анализом ДНК. Скорей всего он оказался самым удобным в
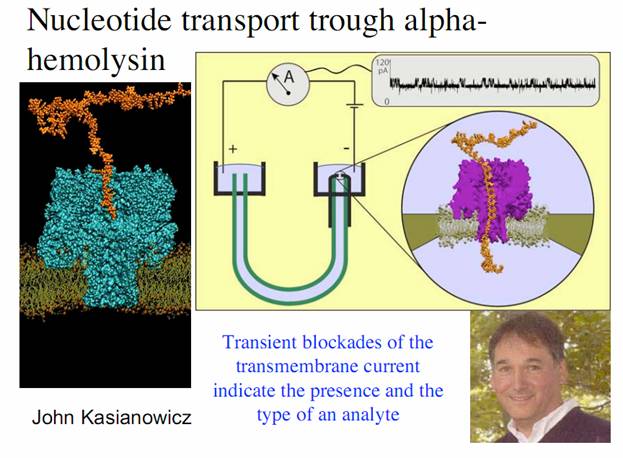
экспериментах и наиболее целесообразным по размерам порообразующим белком. Простейшая экспериментальная установка
показана на фиг.8. Под действием небольшой разности потенциалов, через
единичную пору, встроенную в естественную липидную мембрану, разделяющую два
объема с электролитом, устремляются катионы калия, увлекая за собой гораздо
более крупные органические молекулы, присутствующие в растворе. Небольшой
(сотни пикоампер) ток усиливается операционным усилителем и регистрируется. При
прохождении через пору нейтральной органической молекулы сечение поры сужается
и ток уменьшается. Это позволило судить о диаметре проходящей пору молекулы и
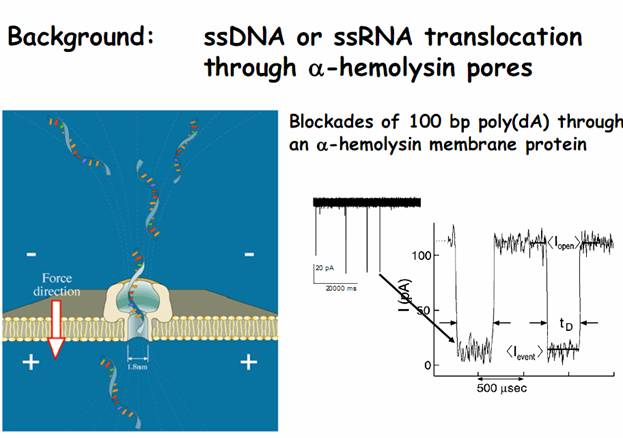
ее длине. Наиболее интересно было экспериментировать с одноцепочечной ДНК
(ssDNA). В ходе
экспериментов очень скоро выяснилось, что можно устойчиво различать отдельные
нуклеотиды цепочки ДНК по мере ее прохождения, т.е. непосредственно считывать
информационный код с конкретного фрагмента ДНК в реальном времени. Это открытие вызвало всеобщий интерес и необоснованную эйфорию
по поводу скорой возможности быстрого и
дешевого индивидуального секвенирования биополимеров, например, здесь. -n_43_ot_21_noyabrya_2006_goda/read_online.html?page=7 Но с тех пор минуло 15 лет, а секвенируют, по-прежнему, методом Сэнгера. В
чем дело, почему столь очевидный принцип не получил ожидаемого развития. Вначале возник ряд, казалось бы, вполне преодолимых
трудностей. http://www.tudelft.nl/live/binaries/eefa57f4-1c28-4e5f-a402 Например, полимерные цепочки слишком быстро проходили через
пору и различить на фоне шума сигналы отдельных нуклеотидов не получалось, так
однонитевая ssDNA длиной в 100 bp пролетала
через пору (фиг. 10 ) всего за 500 микросекунд. http://www.nanonewsnet.ru/news/2010/motornyi -belok-vmesto-elektricheskogo-polya-novyi-shag-k -personalizirovannoi-meditsine Работа Реза Гадири (Reza Ghadiri) и его группы из
Научно-исследовательского института Скриппса (Scripps Research Institute), США,
разрешила основную проблему, сдерживающую развитие основанного на нанопорах
секвенирования ДНК – как заставить ДНК проходить через нанопору настолько
медленно, чтобы можно было считать всю последовательность, основание за
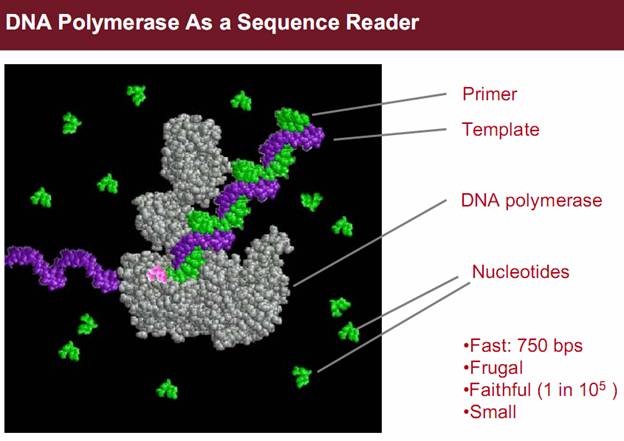
основанием. Гадири решил связать фермент полимеразу – белок, который в
процессе деления клетки природа использует для преобразования одноцепочечной
ДНК в двухцепочечную – с концом цепочки ДНК. Достраивая вторую,
комплиментарную первой, цепочку, моторный белок ДНК-полимераза продвигается по
молекуле ДНК, добавляя основание за основанием. Постепенно, также основание за
основанием, он «протаскивает» исходную цепочку через пору, подтягивая ее к
себе. Процесс протекает с небольшой скоростью, как раз достаточной для того,
чтобы каждый нуклеотид мог быть идентифицирован электрохимическими методами.
«Полимераза – моторный белок», – говорит Гадири. «Она не только
замедляет скорость прохождения ДНК через пору, что очень важно само по себе, но
и вынуждает молекулу делать это в пошаговом режиме». http://www.eternalmind.ru/index.php?option= -com_content&task=view&id=3076&Itemid=1 Также с использованием
ДНК-полимеразы работали профессор Сиз Деккер (Cees Dekker) в Дельфтском
технологическом университете (Delft University of Technology)
(Голландия), Хаганом
Бейли (Hagan Bayley) в Оксфордском университете
(Oxford University(Великобритания) и профессор Сиз Деккер (Cees
Dekker) из Института нанотехнологий
Кавли в Делфте (Kavli Institute of Nanoscience). В их экспериментах использовались уже комбинированные нанопоры, сочетающие в себе искусственные и биологические материалы. Следующий существенный шаг в развитии нанобиотехнологии с
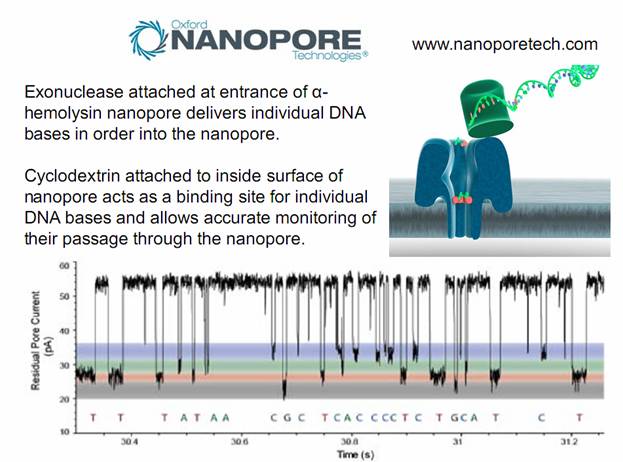
использованием природных нанопор сделали исследователи из Оксфорда, они
применили белки экзонуклеазы в сочетании с молекулой циклодекстрина, встроенной
в нанопору альфа-гемолизина. http://www.nanoporetech.com/sequences Экзонуклеаза последовательно отщепляет мононуклеотиды от полинуклеотидной цепи путем гидролиза фосфодиэфирных
связей, после чего свободные нуклеотиды проходят через нанопору, дополнительно
откалиброванную циклодекстрином, который, как утверждают держатели патента, облегчает
селектирование Т,А,С,G нуклеотидов. «Oxford Nanopore Technologies Ltd» - компания при
университете предлогает комплексную технологию анализа ДНК, в том числе и специальные
чипы, позволяющие работать сразу с целой
матрицей нанопор. На ссылке есть видео. |
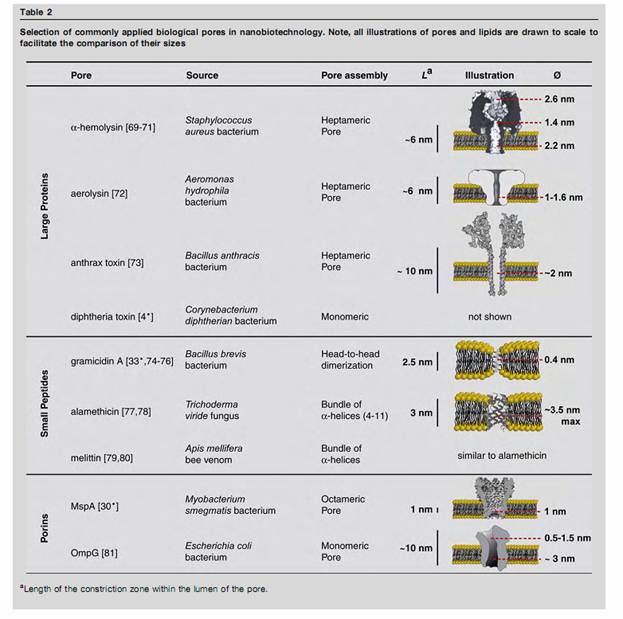
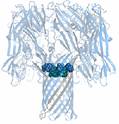
фиг. 7 Белок альфа-гемолизин образует в липидной мембране нанопору, которая по своей структуре идеально подходит для экспериментами с биополимерами
фиг.8 , Органические молекулы, захваченные потоком электролита через нанопору экранируют просвет поры и тем самым модулируют проходящий по цепи ток
Фиг.9 Подробнее о феномене нанопор и механизме порообразования на биологических мембрана http://biomembrane.engin.umich.edu/publications/papers/2010/MajdMayer-1.pdf Фиг.10 Фрагменты ДНК длиной в 100 пар оснований проходят нанопору за 500 микросекунд Фиг.11 ДНК-полимераза достраивает комплементарную цепочку в темпе около 750 оснований в секунду Фиг.12 Новый метод секвентирования. Объединение нанопоры альфа гемолизина с ферментом экзонуклеазы, которая разбирает нуклеотидную цепь звено за звеном, после чего звенья проходят через нанопору и идентифицируются
Фиг.13 В альфа-гемолизин пору встроена колибрующая молекула циклодекстрина, -циклический олигомер глюкозы (видна на фиг.12)
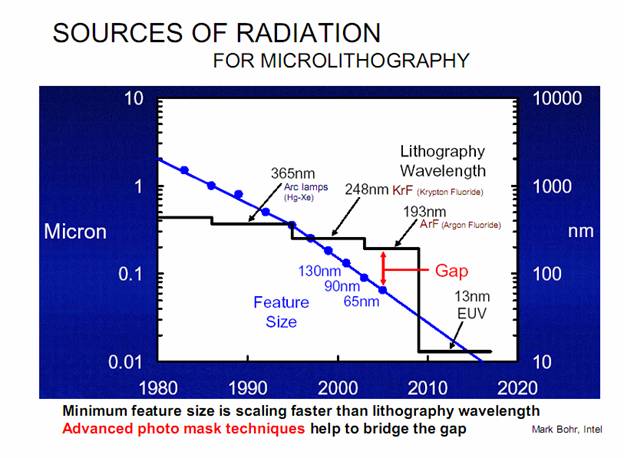
Фиг. 14 Тренд микролитографии. Минимальный контролируемый размер топологии микросхемы.
|
|
Наиболее
полную и свежую подборку по использованию нанопор, применительно к задачам секвенирования,
можно найти в этой публикации. http://online.physics.uiuc.edu/ Но
довольно об
экспериментах с биологическими нанопорами, за 15 лет ожидания и надежды не оправдались, так
и не был создан достаточно убедительный и конкурентоспособный метод секвенирования, пригодный для работы с
конкретной ДНК молекулой. |
Фиг. 15. Фрезерованное ионным пучком отверстие в золотой фольге. |
Фиг. 16. |
|
Тем
временем технология изготовления интегральных схем существенно продвинулась,
появились новые ориентиры и перспективы реализации метода нанопор. https://www.signup4.net/UPLOAD/ANAD10A/TEST1206E/Paulo%20Lozano -%20-%20AFOSR%20materials%20meeting.pdf Мерой технологического уровня отрасли является, так называемый, минимальный контролируемый размер топологии микросхемы (фиг14), корпорация
Intel продолжает свой курс по уменьшению размеров транзисторов на 50% каждые
два года, при этом плотность размещения компонентов на кристалле каждый раз удваивается.
На сегодняшний день, на начало 2011 года
кривую фиг.14 следует дополнить точками 45, 32 и 22 нм, в 2012 году Intel
обещает освоить 10 нм технологию. Величина минимального контролируемого размера определяет возможности
технологов - производителей чипов точно позиционироваться на кристалле кремния
и осуществлять такие технологические операции на его поверхности, как ионное
травление, нанесение масок, а также слоев металла и изоляторов. http://www.compress.ru/Article.aspx?id=20186 Фиг. 15, 16 демонстрируют возможности травления (фрезерования)
нанопор ионным лучем, образцы выполнены на
золотой фольге. http://www.azonano.com/article.aspx?ArticleID=2723&lang=ru Нанопоры
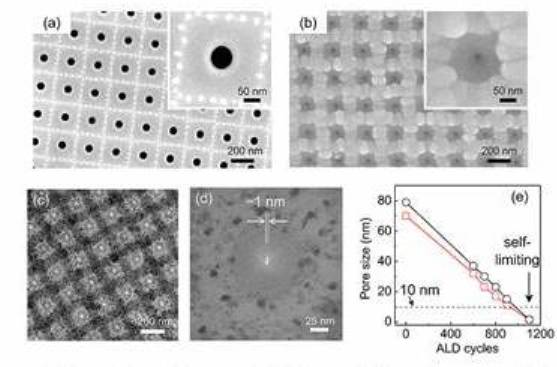
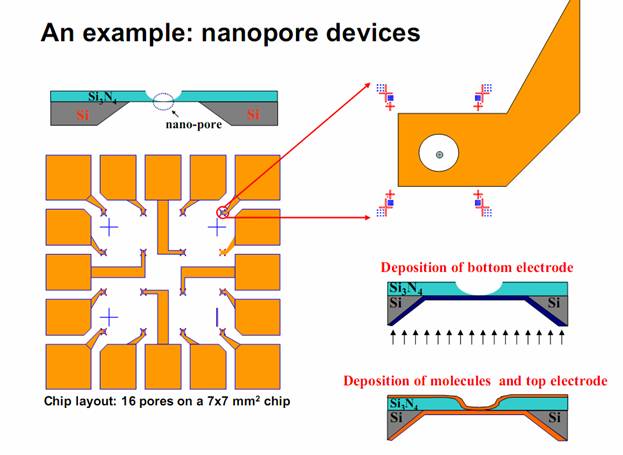
на кремниевом чипе не изготавливают в единичном экземпляре, готовится стазу
матричная структура ( фиг. 18 ), каждая пора имеет свои электроды, а подводящие
дорожки выводят сигналы на край чипа. http://www.seas.upenn.edu/~sunnam/09_2009nanolett_nam.pdf Современная
технология позволяет на том же чипе разместить и операционные усилители
сигнала, и другую электронику, облегчающую сбор информации. Диаметр нанопоры и
глубина канала, а также расположение электродов определяется
последовательностью операций, травления, маскирования, послойного напыления
материалов в вакууме, все эти операции в совершенстве отработаны в технологии
изготовления чипов. |
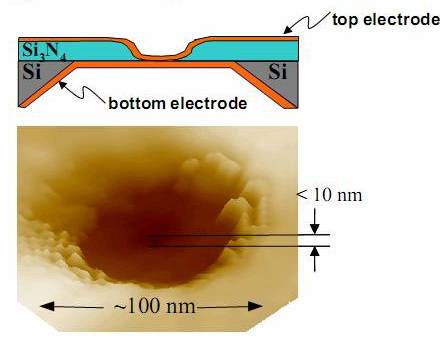
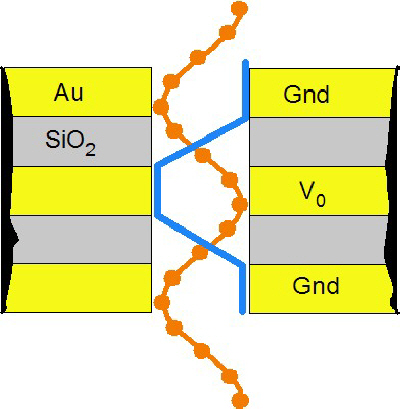
Фиг. 17. Формирование нанопоры
Фиг. 18. После травления требуемый диаметр нанопоры получают напылением слоя нитрида кремния |
|
Похоже, пришло время отказаться
от недолговечных биологических нанопор, хрупких липидных мембран и искусственных
приемов с полимеразой или экзонуклеазой. Появилось новое
понятие, ДНК транзистор,- искусственная нано-структура, выполненная на
кремниевом кристалле инженерными методами.
|
Фиг 19.Чип на 16 нанопор
|
Фиг 20. ДНК-транзистор, условное изображение.
|
|
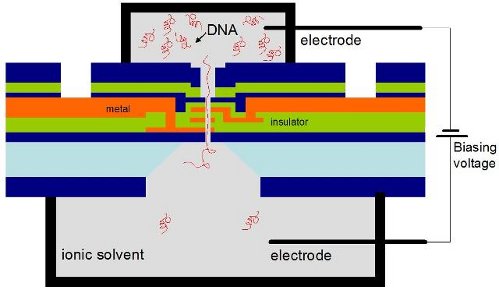
ДНК транзистор, условно показанный на рисунке (Фиг.20), позволяет
останавливать проходящую через пору цепочку ДНК в позиции очередного
дезоксирибонуклеотида и надежно идентифицировать тип нуклеотида. Научиться
делать чипы с матрицей таких нанопор, значит дать в руки биологов мощный
инструмент исследования, а медикам позволить реализовать возможности
индивидуальной медицины. За эту задачу взялись два известных гиганта, - лидер и
законодатель инноваций в микроэлектронике корпорация IBM и Компания Roche,
штаб-квартира которой находится в Базеле (Швейцария). Roche является одной
из ведущих мировых корпораций, ориентированных на исследования
в области фармацевтики и диагностики, ее система секвенирования «454 Sequencing Systems» наиболее
результативна и востребована в молекулярно-биологических лабораториях мира.
Штат сотрудников Группы, включая все отделения по всему миру, составляет
около 80 000 человек. http://m600.org.ua/news/id/30482 http://www.nanostalker.ru/docs/145/ Соглашение подписано в июле 2010 года, первый коммерческий продукт
ожидается не позднее, чем через три года. По своему устройству ДНК-транзистор – это достаточно длинная
нанопора с рядом полупроводниковых и металлических добавок, диаметром всего
несколько нанометров. Взаимодействие с ДНК-полимером реализуется на уровне
отдельных ионов, различать Т,А,С,G нуклеотиды предполагается не по величине ионного тока через
просвет между порой и и биомолекулой, как в более ранних методиках.
Прорабатывается способ идентификации по
частоте, на которой нуклеотид, зафиксированный в канале входит в
резонанс, возможно использование других идей. Впервые люди вышли на реализацию
нано машины, взаимодействующей с органической молекулой по принципу работы
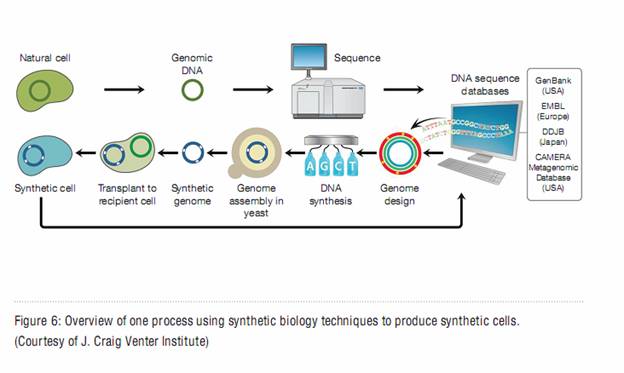
природных наномашин типа полимеразы или других белковых ферментов. И еще одна, очень важная правда. (парадигма по Куну) Решая задачу секвенирования, мы одновременно получаем доступ
в лабораторию природы, возможность синтеза любого наперед задуманного ДНК-, РНК-биополимера
Фиг 22). http://www.bioethics.gov/documents/synthetic-biology/ -PCSBI-Synthetic-Biology-Report-12-16-10.pdf Устройство для синтеза предварительно спроектированной ДНК может
быть реализовано на той же технологической базе, что и сиквент-чипы. По одну сторону
матрацы нанопор-синтезаторов находится раствор А,G пуринов и Т,С пиримидинов, по другую микрополости, в которых ферменты
звено за звеном наращивают ДНК цепочки. Очередная молекула полимера втягивается
в нанопору, идентифицируется, и, если это тот полимер, который требуется, он
направляется в микрокамеру на синтез, если не тот, - он выталкивается обратно в
исходный раствор и цикл повторяется. Появление такого
простого в использовании, производительного вследствие своей многоканальности
устройства сродни изобретению печатного станка. Вложенное в руки сотен ученых-экспериментаторов, оно принесет
результаты, значение которых трудно прогнозировать.
|
Фиг. 21 ДНК-транзистор
Фиг. 22 Биология синтеза.
|
![]()